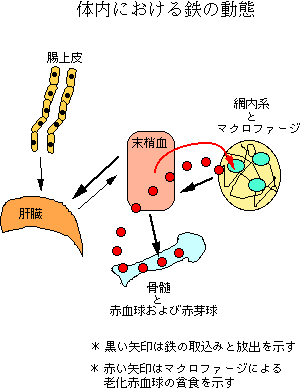
 図に示すように、骨髄では赤血球の前駆細胞である赤芽球が造血に必要な鉄を末梢血から取り込む。骨髄から末梢血に出た赤血球は、正常では120日前後で老化し(透析患者では120日よりも短い)、肝臓や脾臓の網内系マクロファージに捕捉・貧食される。マクロファージは貧食した老化赤血球の鉄をヘモグロビンからフェリチンに移行させて貯蔵する。マクロファージは一方では、貯蔵している鉄の一部を休みなく末梢血に供給し続ける。これにより赤芽球の鉄取り込みによる血清鉄の低下が補われる。
図に示すように、骨髄では赤血球の前駆細胞である赤芽球が造血に必要な鉄を末梢血から取り込む。骨髄から末梢血に出た赤血球は、正常では120日前後で老化し(透析患者では120日よりも短い)、肝臓や脾臓の網内系マクロファージに捕捉・貧食される。マクロファージは貧食した老化赤血球の鉄をヘモグロビンからフェリチンに移行させて貯蔵する。マクロファージは一方では、貯蔵している鉄の一部を休みなく末梢血に供給し続ける。これにより赤芽球の鉄取り込みによる血清鉄の低下が補われる。3.1 体内における鉄の動態
1. 体内における鉄の分布
体重が 60 kg の成人男性では、体内に約4000 mg の鉄を有しており、そのうち2700 mgがヘモグロビンに組み込まれて赤血球に、1000 mg が貯蔵鉄としてと肝臓細胞や網内系マクロファージに存在する。これに対し、末梢血(血漿)に存在する鉄は 3 〜 4 mg に過ぎない。
2. 鉄の体内動態
鉄の体内動態の特徴は、積極的な鉄の排泄機構がなく、鉄は体内で繰り返し再利用されることである。
 図に示すように、骨髄では赤血球の前駆細胞である赤芽球が造血に必要な鉄を末梢血から取り込む。骨髄から末梢血に出た赤血球は、正常では120日前後で老化し(透析患者では120日よりも短い)、肝臓や脾臓の網内系マクロファージに捕捉・貧食される。マクロファージは貧食した老化赤血球の鉄をヘモグロビンからフェリチンに移行させて貯蔵する。マクロファージは一方では、貯蔵している鉄の一部を休みなく末梢血に供給し続ける。これにより赤芽球の鉄取り込みによる血清鉄の低下が補われる。
図に示すように、骨髄では赤血球の前駆細胞である赤芽球が造血に必要な鉄を末梢血から取り込む。骨髄から末梢血に出た赤血球は、正常では120日前後で老化し(透析患者では120日よりも短い)、肝臓や脾臓の網内系マクロファージに捕捉・貧食される。マクロファージは貧食した老化赤血球の鉄をヘモグロビンからフェリチンに移行させて貯蔵する。マクロファージは一方では、貯蔵している鉄の一部を休みなく末梢血に供給し続ける。これにより赤芽球の鉄取り込みによる血清鉄の低下が補われる。
肝細胞は末梢血から鉄を取り込み、末梢血へ鉄を供給する。しかし、肝細胞による末梢血への有意な量の鉄の供給は鉄欠乏の際にしか生じない。すなわち、肝臓は主に鉄の貯蔵庫として機能する。
経口的に摂取された鉄は、鉄欠乏がない限り、ほとんど便中に排泄される。具体的には、経口的に摂取された鉄は、まず腸上皮細胞に吸収されて蓄えられる。鉄欠乏があれば、その後、その程度に応じてこのようにして腸上皮細胞に貯蔵された鉄の一部が末梢血に供給される。しかし、鉄欠乏がなければ、腸上皮細胞に貯蔵された鉄は、腸上皮細胞の剥離・脱落に伴なって便中に排泄される(腸上皮細胞は約2日で剥離・脱落する)。
以下に、それぞれの関係臓器からみた体内の鉄の動態について、より詳しく記載する。
a.
肝細胞を中心とした鉄の動態
末梢血中では、鉄は主に血清蛋白のひとつであるトランスフェリンに結合した形態で存在するが、一部はフェリチンに結合した形態でも存在する。トランスフェリンに結合した鉄は肝細胞膜にある受容体に結合して細胞内に取り込まれる。肝細胞に取り込まれた鉄は細胞内に貯蔵され、鉄が欠乏した際に末梢血に供給される。
肝細胞から末梢血への鉄の供給はフェロポーティン(ferroportin)という肝細胞膜に存在する蛋白質とヘプシジン-25(hepcidin-25)という末梢血に存在するポリペプチドにより制御される。具体的には、鉄はフェロポーティンを介して肝細胞から末梢血に供給され、ヘプシジン-25は、フェロポーティンと結合することによりこれを消滅させる。
ヘプシジン-25の産生(肝臓で産生される)は血清鉄が減少したときに低下し、血清鉄が十分に存在するときに亢進する。そこで、血清鉄が減少したときには、フェロポーティンを介しての肝細胞から末梢血への鉄の供給は抑制されないが、血清鉄が増加するとフェロポーティンを介する肝細胞から末梢血への鉄の移動は抑制される。
なお、後に述べるように、網内系マクロファージから末梢血への鉄の供給にも、肝細胞の場合と同様にフェロポーティンとヘプシジン-25が関係している。
マクロファージには肝細胞に比べて多量のフェロポーティンが分布している。これは、末梢血に鉄を供給する主な細胞は肝細胞ではなくマクロファージであることを示している。すなわち、血清鉄の量を一定にコントロールするのはマクロファージであり、肝細胞はむしろ鉄の貯蔵庫として機能している。
なお、鉄原子は細胞毒であり、肝細胞内でも、またマクロファージ内でも、毒性が発現しないように鉄結合性蛋白であるフェリチンと結合した形態で貯えられている。
b.
網内系マクロファージを中心とした鉄の動態
網内系マクロファージは、老化した赤血球を貧食することにより、細胞内にヘモグロビンに組み込まれた鉄を取り込む。すなわち、赤血球が肝臓や脾臓の網内系を通過する際、それらのうち老化した赤血球はマクロファージに捕捉・貧食される。そして、捕捉・貧食された老化赤血球のヘモグロビンから鉄が引き離され、引き離された鉄はマクロファージ内にフェリチンと結合した状態で貯蔵される。このように、網内系マクロファージへの鉄の取り込みは、寿命を終えた老化赤血球の捕捉・貧食を介して行われる。
さて、マクロファージから末梢血への鉄の放出も、肝臓から末梢血への鉄の放出と同様に、細胞膜に存在するフェロポーティンと末梢血中に存在するヘプシジン-25により制御される。すなわち、血清鉄が減少したときにはヘプシジン-25の産生が低下してフェロポーティンを介する末梢血への鉄の供給が促進され、逆に十分な量の血清鉄が存在するときにはヘプシジン-25の産生は増大してフェロポーティンを介する末梢血への鉄の移動は抑制される。
網内系マクロファージの細胞膜には肝細胞膜よりも豊富にフェロポーティンが分布している。したがって、マクロファージは末梢血に鉄を供給する作用が肝細胞よりも強い。すなわち、マクロファージは血清鉄の量を一定にコントロールする中心的な役目を果たしている。
c.
赤血球を中心とした鉄の動態
骨髄において赤血球系の前駆細胞から分化した赤芽球は、細胞表面に鉄-トランスフェリン複合体に対する受容体を有し、末梢血中から細胞内に、トランスフェリンに結合した鉄を取り込む。取り込まれた鉄は、ヘモグロビンを合成するため利用される。なお、前駆細胞から赤芽球への分化はエリスロポエチンに支配されているため、エリスロポエチンが欠乏していれば、前駆細胞は赤芽球に分化することができない。
赤芽球が鉄を取り込んで赤血球に分化すると、赤血球は骨髄から末梢血にでる。末梢血にでた赤血球のうち、寿命が平均120日に達した老化赤血球量は肝臓や脾臓の網内系マクロファージに捕捉・貧食される。
d. 腸上皮細胞
経口摂取した鉄は腸上皮細胞に取り込まれ、フェリチンと結合した状態で貯蔵される。腸上皮細胞は2日程度で剥離・脱落するが、生体に鉄が十分に足りている状態では、貯蔵された鉄のほとんどが腸上皮細胞の剥離・脱落とともに便中に排泄される。これに対して、生体で鉄が欠乏している場合には、ヘプシジン-25の産生が低下して、腸上皮細胞に貯蔵された鉄の一部が腸上皮細胞が剥離・脱落する前にフェロポーティンを介して末梢血に放出される。
e.
末梢血を中心とした鉄の動態
ヘモグロビンの合成のため、骨髄においては1時間あたり
0.8〜1.0 mg
の速度で末梢血から赤芽球に鉄が取り込まれている。一方、マクロファージからは同じ速度で末梢血へ鉄が供給されている。このように造血のための末梢血から赤芽球への鉄の取り込みは、マクロファージから末梢血への同量の鉄の供給によって補われ、以って末梢血中の鉄の量は一定に維持されている。
鉄が過剰に存在するときには、鉄は末梢血から肝細胞に取り込まれて貯蔵される。しかし、鉄が欠乏しているときを除いて、肝細胞から末梢血へ供給される鉄はわずかである。そこで、結果として肝臓は鉄の貯蔵庫となる。また、鉄が欠乏しているときを除いて、実質的に鉄が腸上皮細胞を介して腸から末梢血へ吸収されることはない。一方、体内には、過剰に存在する鉄を体外に排泄する経路は存在しない。
すなわち、出血などで鉄が体外に失われたとき、あるいは不適切な経静脈的な鉄の投与、あるいは輸血などにより鉄が体内に供給されたとき以外には、体内で急速な鉄の過不足は生じない。
なお、透析患者は、ダイアライザーへの残血や定期的な採血のために鉄欠乏に陥りやすい反面、経静脈的な鉄の過剰投与あるいは輸血のために鉄過剰の状態になることも多い。
3. 貯蔵鉄の放出におけるヘプシジン-25の役割
マクロファージ、肝細胞および腸上皮細胞から末梢血への鉄の放出は、それぞれ細胞膜に存在するフェロポーティンを介して行われる。一方、フェロポーティンはヘプシジン-25により無力化される。すなわち、末梢血中のヘプシジン-25が、その受容体である細胞膜のフェロポーティンに結合してフェロポーティンヘプシジン複合体が形成されると、フェロポーティンーヘプシジン複合体はエンドサイトーシスにより細胞内に移動し、ライゾゾームで分解される。このように、末梢血へ鉄を供給するマクロファージ、肝細胞および腸上皮細胞の機能は、末梢血中のヘプシジン-25により抑制される。フェロポーティンがヘプシジン-25と結合して消滅した後、細胞膜にフェロポーティンが復活し、細胞の鉄供給能が回復するのに2〜3日を要する。
ヘプシジンは、肝臓で産生されて末梢血に流出し、マクロファージ、肝細胞および腸上皮細胞に作用する低分子ポリペプタイドである。ヘプシジンの産生は、(1)鉄が過剰に存在する場合以外に、(2)持続性の炎症が存在する場合、(3)エリスロポエチン欠乏などにより骨髄機能が低下している場合にも亢進する。いずれの場合にも、末梢血への貯蔵鉄の供給が低下する。したがって、この状態で鉄剤を投与すると、貯蔵鉄が増加して次に述べるような障害が発生するおそれがでてくる。
なお、鉄剤の投与の必要性を決定するのに血清ヘプシジン値の測定が有用であると考えられている。しかし、血清ヘプシジン値の測定は、現時点ではまだ十分に普及していない。ヘプシジンの前駆体であるプロヘプシジン(prohepcidin)のELISA測定キット(コスモ・バイオ株式会社、竹田理化工業株式会社)が市販されている。
4. 過剰となった鉄による障害
基本的に、生体にとって鉄は有害物質である。例えば、鉄イオンはフリーラジカルの産生を促進して細胞を傷害する。
臨床的には、鉄過剰状態では心筋梗塞のリスクが増大すると報告されている[1]。また、腎不全患者において血清フェリチン値が 500 ng/mL を越えると死亡のリスクが 2.7倍に上昇するとの報告がある[2]。さらに、6ヶ月間に1000 mg 以上の鉄が投与された患者群では死亡のリスクが上昇したとの報告もある[3]。したがって、前田らが理想的鉄欠乏状態と表現したように[4]、貯蔵鉄の量は少なめである方が望ましいと考えられる。
なお、血清フェリチン値は肝細胞や網内系マクロファージに貯蔵されている鉄の量(貯蔵鉄の量)を反映している。
5. 生体における適正な鉄の状態
すでに述べたように、過剰な貯蔵鉄は生体に有害な作用を及ぼす。一方、末梢血には造血に必要な量の鉄が存在していなければならない。したがって、貯蔵鉄量は多すぎず、末梢血の鉄量は少なすぎないことが必要である。
1. Klipstein-Grobusch K, et al.: Serum ferritin and risk of myocardial infarction in the elderly; Rotterdam Study. Am J Clin Nutr 69: 1231-1236, 1999.
2. Mezzano D, et al.: Inflammation, not hyperhomocysteinemia, is related to oxidative stress and hemostatic and endothelial dysfunction in uremia. Kidney Int 60: 1844-1850, 2001.
3. Feldman HI, et al,: Iron administration and clinical outcomes in hemodialysis patients. J Am Soc Nephrol 13: 734-744, 2002.
4. 前田貞亮、他:血液透析患者の鉄の至適指標は低フェリチン高TSAT. 日本透析医会雑誌 22: 242-249, 2007.