文献では、ドライウェイトを「透析中に血圧低下などの症状が生じないような体重であって、かつ患者が耐えられるできるかぎり低い体重」と定義している[1]。このドライウェイトの定義では、体液量が腎機能が正常である人と同レベル であって、かつ透析中に血圧低下を生じないような体重が存在することを前提としている。ところが、実際には、 体液量が腎機能が正常である人と同レベルであるような体重、すなわち非透析時にも浮腫がなく、血圧も正常な範囲内にあるような体重にドライウェイトを設定しようとすると、一部の患者では透析中には血圧が低下し、透析後には倦怠感や筋肉のこむら返りなどの症状が出現する。一方、透析中に血圧低下などの症状が生じないような体重にドライウェイトを設定しようとすると、非透析時に高血圧や著明な浮腫が出現し、ときに肺水腫に陥る患者が現れる。
すなわち、高齢であり、また糖尿病などを原疾患とする患者が増えたため、現在ではかつてのドライウェイトの定義をそのまま適用することができない患者がみられるようになった。
2. 高齢の患者や糖尿病の患者にドライウェイトの定義を そのままでは適用できない理由
a. 循環動態の概説
心臓のすぐ手前の静脈(大静脈)の圧である中心静脈圧(CVP)は、心臓からの血液の拍出量(心拍出量)を増加させる最大の因子である。すなわち、中心静脈圧が高ければ高いほど、心拍出量は増加
し、これが低ければ低いほど心拍出量は低下する。一方、心臓から拍出される血液の各臓器への配分は、各臓器における動脈末端、すなわち細動脈の壁を取り巻く輪状の平滑筋(毛細血管前括約筋)の収縮と弛緩により調整される。
今、例えば、何らかの理由により中心静脈圧が低下すると、それに伴なって心拍出量が低下する。心拍出量が低下すると、皮膚などの酸素需要(必要血流量)が低い臓器では、毛細血管前括約筋が収縮し、血液供給
は減少する。これにより、皮膚などの酸素需要が低い臓器への血流は、消化器系臓器や脳などの酸素需要が高い臓器に振り向けられる。心拍出量がさらに低下すると、皮膚などの
酸素需要が低い臓器の毛細血管前括約筋はより強く収縮し、一方では、消化器系臓器や脳などの酸素需要が高い臓器の毛細血管前括約筋は弛緩して、これらの臓器への血液供給量はそれでもなお維持される。
すなわち、心拍出量が低下すると、心臓から拍出される血液は優先的に消化器系臓器や脳などの血液供給量の減少に耐えられない臓器に優先的に供給されるようになる。このとき、皮膚などの
酸素需要が低い臓器では、毛細血管前括約筋の収縮により血管抵抗が増加し、一方、消化器系臓器や脳などの酸素需要が高い臓器では、血管抵抗は増加しないか、あるいは毛細血管前括約筋の弛緩により
むしろ減少する。その結果、体内の総合の血管抵抗である総末梢血管抵抗が心拍出量の低下を補えれば血圧は維持されるが、これが心拍出量の低下を補うことができなければ血圧は低下する。
さて、高齢の透析患者や糖尿病の患者では、しばしば心筋の収縮力が低下していたり、あるいは心筋の伸展性が低下しており、そのために、より高い中心静脈圧でなければ正常の心拍出量を保てなくなっている。一方、中心静脈圧は体内に貯留する水分量が多ければ多いほど高くなる。したがって、高齢の透析患者や糖尿病を合併する透析患者では、しばしば体内により多くの水分を貯留させていなければ、正常な心拍出量を維持できない。これが高齢の患者や糖尿病の患者に
古典的なドライウェイトの定義を
ただちには適用できない別の理由である。
一方、高齢の透析患者や糖尿病の患者では、しばしば諸臓器の毛細血管前括約筋に収縮刺激信号を送る自律神経(交感神経)機能が低下している。したがって、このような患者では、ときに心拍出量が低下しても皮膚などの
酸素需要が低い臓器で毛細血管前括約筋が十分に収縮することができない。その結果、高齢の透析患者や糖尿病の患者では総末梢循環抵抗を上昇させることにより心拍出量の低下を補って血圧を維持することができず、透析中に除水による心拍出量の低下に伴なって血圧が低下するようになる。これが高齢の患者や糖尿病の患者にドライウェイトの定義をただちには適用できない別の理由である。
以下に、血圧、心拍出量、総末梢循環抵抗のぞれぞれについて、さらに詳しく述べる。
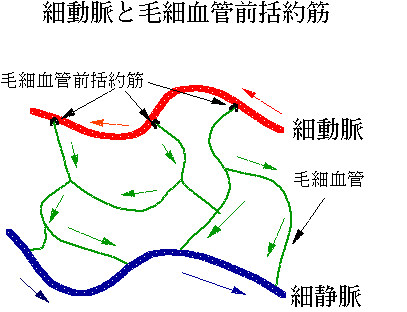
b. 血圧
心臓から出た動脈である大動脈は、分枝を繰り返して次第に細くなり、やがて細動脈を経て毛細血管に移行する。毛細血管は反対側で細静脈に繋がり、細静脈はいくつかが合流してしだいに太い静脈となり、上大静脈および下大静脈を経て心臓に繋がる。心臓から拍出された血液はこのような経路を通って、すなわち細動脈を経て毛細血管に流れ込むのであるが、その際、血液は細動脈と毛細血管との境界の細動脈側にある生理的狭窄部位を通過する。図に示すように、この狭窄部位は細動脈上に存在する毛細血管前括約筋(precapillary
sphincter)が細動脈と毛細血管の連結部を締め付けることにより形成される。毛細血管前括約筋は交感神経に支配されており、交感神経の緊張度が亢進するとより強く収縮し、その結果、細動脈の血管抵抗は増大する。
さて、血圧は心拍出量が多いほど、また細動脈を取り巻く毛細血管前括約筋の緊張度が高いほど(総末梢血管抵抗が大きいほど)高くなる。この関係を以下の式に示す。
平均血圧=心拍出量 ×総末梢血管抵抗 (1)
c. 心拍出量
血圧を決定する、上記の式(1)の右辺を構成するふたつの因子のうちの心拍出量は、心臓のすぐ手前の静脈の内圧(中心静脈圧)と心筋収縮力によって決定される。一方、中心静脈圧は静脈に分布する血液の量により決定される。さて、体内の血液の約
70%
は静脈に分布し、また血液量の増減は主に静脈に分布する血液量の増減による。したがって、非透析時、体内に過剰に水分が貯留すると、静脈に分布する血液の量が増加し、その結果、中心静脈圧が上昇して心拍出量が増加、血圧が上昇する。一方、これとは逆に、透析中に除水をおこなうと、静脈に分布する血液の量は
次第に減少し、その結果、中心静脈圧が次第に低下して心拍出量は低下、血圧は下降する。
d.
総末梢血管抵抗
式(1)が示すように、血圧は心拍出量と総末梢血管抵抗の積である。そして、ある程度までの心拍出量の低下は
総末梢血管抵抗の増大で補われ、血圧は維持される。
さて、すでに述べたように、総末梢血管抵抗は細動脈と毛細血管の連結部の細動脈上に存在する毛細血管前括約筋の緊張度により決定される。例えば、透析中、除水にともなって心拍出量が低下すると、正常ではその程度に応じて細動脈の毛細血管前括約筋の緊張度が増大し、血圧の低下が防がれる。しかし、このとき、全身の臓器で毛細血管前括約筋が一様に緊張度を増すのではない。まず、皮膚の細動脈毛細血管前括約筋が緊張度を増す。心拍出量がさらに低下すると、次は筋肉の細動脈毛細血管前括約筋の緊張度が増す。
細動脈の毛細血管前括約筋の緊張度が増すと、血圧は保たれるが、毛細血管前括約筋より先への血流は減少する。皮膚の血流量が減少すれば、皮膚は蒼白となり、皮膚温は低下する。これが高度になれば発汗が生じる。一方、筋肉の血流量が減少すると、筋肉細胞の代謝が障害され、いわゆる倦怠感が生じる。また、筋肉の血流量の減少に何らかの因子(おそらく電解質のある種のアンバランス)が加わると筋肉のこむら返りが生じる。消化器系臓器や脳などの代謝が活発な臓器(酸素需要の大きな臓器)では、血流が減少すると局所で半減期が極めて短い血管拡張物質が産生される。そのため、代謝が活発な臓器ではたとえ血圧がある程度低下しても最後まで血流は保たれる。しかし、血管拡張物質の産生増加にともなう局所血流の増加が血圧低下による局所血流の減少を相殺できなくなると、それぞれの臓器に特有な症状が現れる。消化器系臓器であれば、腸音の消失をともなう激しい腹痛が出現し、脳血流量が低下し始めると、最初はあくびが生じ、さらに血流量が減少すると意識を失う。なお、透析中に血圧低下と伴に腹痛が生じ、このとき、しばしば腸音はむしろ亢進している。このような腹痛は、血圧低下に伴なって自律神経機能のうち、交感神経機能が亢進し、これに伴なって反射的に副交換神経(迷走神経)機能も亢進するために生じる。
a.
自律神経失調症を合併する患者におけるドライウェイトと中心静脈圧の関係
透析中に血圧が著しく低下することがないようにしようとするなら、血圧を維持できるだけの心拍出量が得られるようにしなければならない。血圧を維持できるだけの心拍出量は、総末梢血管抵抗が十分に増大できる場合、とくに血液供給の取りあえずの必要性が低い皮膚などの臓器において、毛細血管前括約筋の収縮による血管抵抗が十分に増大できる場合には、比較的少なくて済む。しかし、自律神経失調などで毛細血管前括約筋が十分に収縮できず、そのために血管抵抗が十分に増大できない場合には、血圧を維持するのに必要な心拍出量はより多くなる。ところが、心拍出量を増大させる最大の因子は中心静脈圧であり、そして中心静脈圧は体内に貯留する水分の量が多いほど上昇する。したがって、自律神経失調などで毛細血管前括約筋が十分に収縮できず、そのために血管抵抗を十分に増大させられない患者では、ドライウェイトを「透析中に血圧低下などの症状が生じないような体重であって、かつ患者が耐えられるできるかぎり低い体重」と定義するかぎり、体内により大量の水分を貯留させておかなくてはならない。すなわち、重症の自律神経失調を合併している患者では、心拍出量の中等度の低下に対しても血圧が維持されないので、血圧低下を防ごうとするなら体液量が十分に減少する前に除水を終了せざるをえない。
しかし、透析中における心拍出量の低下が緩徐であれば、自律神経機能は心拍出量の低下を何とか代償できることが多い。すなわち、総除水量が少なくてすむように食事内容(主に塩分摂取量)について患者を指導し、あるいは透析時間を延長するなどして除水速度を緩徐にすれば、かなりの程度まで透析中の血圧低下を防ぐことができる。また、塩酸ミドドリン、メチル硫酸アメジニウムやドロキシドパなどの交感神経刺激薬(昇圧剤)の投与によって、必要な量の除水が可能になることも多い。さらに、透析中、透析スタッフが患者に頻繁に声をかけるなど、患者に適度な刺激を与え続けると、自律神経機能が維持されて、除水量を増やすことができるようになる。しかし、決まった数の透析スタッフが多くの患者を担当せざるをえない現在の透析センターでは、このような対応は現実には不可能かもしれない。
透析中に血圧が著しく低下することがないようにしようとするなら、血圧を維持できるだけの心拍出量が得られるようにしなければならない。血圧を維持できるだけの心拍出量は、総末梢血管抵抗が十分に増大できる場合、とくに
血液供給の取りあえずの必要性が低い皮膚などの臓器において、毛細血管前括約筋の収縮による血管抵抗が十分に増大できる場合には、比較的少なくて済む。しかし、自律神経失調などで毛細血管前括約筋が十分に収縮できず、そのために血管抵抗が十分に増大できない場合には、血圧を維持するのに必要な心拍出量はより多くなる。ところが、心拍出量を増大させる最大の因子は中心静脈圧であり、そして中心静脈圧は体内に貯留する水分の量が多いほど上昇する。したがって、自律神経失調などで毛細血管前括約筋が十分に収縮できず、そのために血管抵抗を十分に増大させられない患者では、ドライウェイトを「透析中に血圧低下などの症状が生じないような体重であって、かつ患者が耐えられるできるかぎり低い体重」と定義するかぎり、体内により大量の水分を貯留させておかなくてはならない。すなわち、重症の自律神経失調を合併している患者で透析中に血圧低下が生じないようにしようとするなら、ドライウェイトをより高く設定しなければならない。しかし、ドライウェイトを高く設定すると肺水腫のリスクも増大する。
b. 心不全を合併する患者におけるドライウェイトと中心静脈圧の関係
心筋の収縮力が低下していたり、あるいは心筋の伸展性が低下している患者では、中心静脈圧が等しいなら、心臓にこのような問題を有しない患者に比べて心拍出量は低下している。したがって、心筋の収縮力が低下していたり、あるいは心筋の伸展性が低下している患者で心臓に問題を有しない患者と同程度の心拍出量を得ようとすると、より高い中心静脈圧が必要
となる。すなわち、心筋の収縮力が低下していたり、あるいは心筋の伸展性が低下している患者で透析中に血圧低下が生じないようにしようとすると、体内により大量の水分を貯留させて、心拍出量を正常のレベルに維持し
なければならない。換言すると、心機能が低下している患者で、透析中に血圧低下が生じないようにしようとするなら、自律神経失調の患者の場合と同様に、ドライウェイトをより高く設定しなければならない。しかし、中心静脈圧を高く保つと、すなわち体内の水分の貯留量を増加させると、全身に浮腫が出現し、また体内の水分の貯留量があるレベルを越えて増加すると肺水腫も生じる。
c. ドライウェイトの決定
もしドライウェイトを「透析中に血圧低下などの症状が生じないような体重であって、かつ患者が耐えられるできるかぎり低い体重」と定義するなら、一部の患者では全身の浮腫と肺水腫のリスクを許容しなければならない。一方、もしドライウェイトを「浮腫が認められず、肺水腫のリスクも極めて少ない体重」と定義するなら、自律神経失症や心不全を有する患者では、透析中の
ある程度の血圧低下は許容しなければならない。
実際には、この2つの定義に基づくそれぞれのドライウェイトの中間を取ることが多いと思われるが、それぞれの医師がどの定義をより重視するかで、施設ごとにドライウェイトの厳しさが異なる
だろう。
d. 低すぎるドライウェイト
自律神経失調症や心不全を有していない患者であっても、ドライウェイトを低すぎるレベルに設定すると、中心静脈圧が正常レベル以下に低下し、これに伴なって心拍出量が正常レベル以下に低下する。しかし、
このような患者では心拍出量の低下が末梢循環抵抗値の上昇で補われるので、ある程度ドライウェイトを低めに設定しても血圧は維持される。このような場合、心拍出量の低下を補って血圧を維持するために、交感神経系の緊張度が上昇して皮膚の毛細血管前括約筋が収縮
する。皮膚の毛細血管前括約筋の収縮による総末梢血管抵抗の増大だけで心拍出量の低下を補って血圧を維持することができないようなら、骨格筋の毛細血管前括約筋も収縮する
。
皮膚の毛細血管前括約筋が収縮すると顔色は蒼白となり、骨格筋の毛細血管前括約筋が収縮すると筋肉のこむら返りや倦怠感が生じる。
メトリジン錠2mg
(大正製薬)
アバルナート錠2mg
(東和薬品)
メトドリン錠2mg
(メディサ新薬)
ナチルジン錠2mg
(大洋薬品)
■メチル硫酸アメジニウム
リズミック錠10mg
(大日本製薬)
ダイアリード錠10mg
(扶桑薬品)
オフビット錠10mg
(大正製薬)
メトロック錠10
(東和)
アコミック錠10
(大洋)
アメジニン錠10mg
(日医工)
■ドロキシドパ
ドプス Dops
カプセル:100・200mg
細粒:20%
(大日本住友)
ドロキシドパ「マイラン」
カプセル:100・200mg
細粒20%
(マイラン)
ドロキシドパ「アメル」
カプセル:100・200mg
(共和)
ドロキシドパ「日医工」
カプセル:100・200mg
(日医工)
4. 各指標の生理学的な意味
a.
中心静脈圧を反映する指標
ドライウェイトを決定するための指標の多くは、中心静脈圧を反映する。したがって、ドライウェイトとは適正な中心静脈圧の下における体重であると考えられる。
1) 心胸郭比(CTR)
心臓は心筋という筋肉でできたポンプである。心筋が収縮することにより心臓は血液を拍出する。一方、心筋は自ら収縮はするものの、自ら伸展はしない。一旦収縮した心臓が再び拡張するのは心筋が自ら伸展するからではなく、僧帽弁と三尖弁が開くことにより
、その上流(右心室の場合は上大静脈と下大静脈、左心室の場合は肺静脈)の圧がそれぞれ左心室内と右心室内に伝わり、伝わった圧により左心室と右心室が押し広げられるからである。そして、左心室と右心室がより大きく押し広げられれば心胸郭比は大きくなり、左心室と右心室の押し広げられる程度が
小さければ心胸郭比は小さくなる。すなわち、中心静脈圧と肺静脈圧(両者は並行して変動する)がより高ければ心胸郭比はより大きくなり、これらがより低ければより小さくなる。これらの事実は心胸郭比が中心静脈圧を反映する指標であり、心胸郭比の大小は中心静脈圧の高低を見ていることを示している。
しかし、心筋のコンプライアンス(心筋の硬さ)は個々の患者によって異なる。例えば、心筋にカルシウムやアミロイドが沈着すると心筋のコンプライアンスは小さくなる(心筋は硬くなる)とされている。そして、心筋のコンプライアンスが小さくなると、中心静脈圧が高くなってもそれほどには心胸郭比は大きくはならない。すなわち、このような患者では心胸郭比から推定される中心静脈圧は過小評価されることになる。
2) 心房性Na利尿ホルモン(hANP)
血漿hANP濃度は、ドライウェイトの決定に有用な指標として広く利用されている。すなわち、透析終了後の血漿 hANP 濃度が 25 〜 60pg/dl の範囲あるいはこの範囲の上限付近にある場合に患者はドライウェイトの状態にあるとされ、透析終了後のhANP が 100pg/dl 以上の場合
にはドライウェイトは高すぎると判定される。
さて、hANP は心房から分泌される半減期が短いホルモンであり、心房が伸展されると分泌量が増大する[2,3]。ところが、心房の伸展程度は心房内圧が高ければ高いほど大きい。そして、左心房の場合にはその内圧はそのすぐ上流にあたる肺静脈の圧に等しく、右心房の場合には同様にそのすぐ上流にあたる
大静脈圧の圧(中心静脈圧)に等しい。一方、肺静脈圧と中心静脈圧は並行して変動する。したがって、hANP の血漿濃度は中心静脈圧を反映
することになる。
3) 下大静脈径(IVC)
超音波エコー検査により測定された吸気時の下大静脈径がドライウェイトの決定の際に参考指標として利用される。すなわち、ドライウェイトが適正である場合には、透析終了後の吸気時における下大静脈径は 6 〜10mm
となるとされている。
下大静脈径は下大静脈の圧、すなわち中心静脈圧が高いほど高く、これが低いほど低いので、下大静脈径は中心静脈圧を反映しているといえる。
4) 浮腫の有無
浮腫の有無、とくに下肢の浮腫の有無は、ドライウェイトが適正か否かを評価する際に有用な判断基準とされている。浮腫とは間質に過剰に体液が分布している状態である。
さて、体液は細胞の中に分布する細胞内液と血管の中に存在する血漿と血管の外であって、細胞の外でもある間質に分布する間質液に分類される。つまり、細胞は間質液に浸された状態で存在し、間質には運河のように血管が分布
する。細胞で必要な物質は間質液から細胞に取り込まれ、細胞で産生された老廃物は間質液中に排泄される。一方、間質液中に不足した物質は間質に分布する血管のうち、もっとも壁が薄い毛細血管の壁を通して間質液中に補給され、間質液中に蓄積した細胞由来の老廃物
は毛細血管の壁を通して血液中に移行する。
このような構造においては、中心静脈圧が高くなるとその最上流である毛細血管の内圧も高くなる。毛細血管の内圧が高くなると毛細血管を流れる血液から毛細血管外、すなわち間質に漏れ出していく水分の量も多くなる。その結果、間質に分布する体液量は増加して浮腫が生じる。
このように、浮腫の原因のすべてではないが、その多くは中心静脈圧の上昇である。したがって、浮腫の有無、あるいはその程度は通常、中心静脈圧の高低を反映している。
b. 心拍出量を反映する指標
1) 血圧
すでに述べたように、血圧は心拍出量と総末梢血管抵抗の両方に比例する。すなわち、血圧は総末梢血管抵抗の指標であると同時に心拍出量の指標でもある。
総末梢血管抵抗を増大させる機能が低下している患者、すなわち自律神経機能が低下している患者(糖尿病の患者や高齢の患者に多い)では、総末梢血管抵抗の上昇程度が限られているので、血圧はより心拍出量を反映する。したがって、自律神経機能が低下している患者では除水とともに中心静脈圧が低下し、その結果として心拍出量が低下すると、心拍出量の低下に伴なって血圧が徐々に低下していく。
一方、総末梢血管抵抗を増大させる機能、すなわち自律神経機能が正常である患者では、心拍出量がある程度低下しても総末梢血管抵抗の増大でこれを代償する
。したがって、その結果、血圧はさほどは低下しない。つまり、このような患者では血圧は必ずしも心拍出量を反映する指標ではない。
2) 左心室駆出率(ejection
fraction; EF)
心拍出量の直接的指標には心臓超音波検査所見における左心駆出率がある。透析終了後の EF が 50% 程度になるように除水をおこなうのが適切であるとされている。
3) こむら返り、倦怠感
透析後半あるいは終了後にみられるこむら返りや倦怠感は、筋肉(骨格筋)の血流量が低下したときに生じる。
骨格筋の血流は、骨格筋に分布する血管の流量抵抗が大きいほど、また血圧が低いほど低下する。そして、骨格筋に分布する血管の流量抵抗は、細動脈の末端にある毛細血管前括約筋の収縮の程度で決定される。
さて、自律神経機能が正常あるいは正常に近い患者では、除水に伴なって心拍出量が軽度に低下すると、皮膚などの酸素需要(必要血流量)が低い臓器に分布する細動脈の毛細血管前括約筋が収縮
する。その結果、心臓から拍出された血液の皮膚などの酸素需要が低い臓器への分配比率は低下し、消化器系臓器や脳などの酸素需要が高い臓器への分配比率が増加する。
すなわち、消化器系臓器や脳などの血流量は維持されるが、皮膚の血流量は低下する。
自律神経機能が正常あるいは正常に近い患者では、心拍出量がさらに低下すると、骨格筋に分布する細動脈の毛細血管前括約筋も収縮するようになり、その結果、心臓から拍出された血液の骨格筋への分配比率は低下し、消化器系臓器や脳などの血流はなお保たれる。そして、心拍出量が高度に低下した結果、このような状態が生じると、こむら返りや倦怠感などの症状が生じる。すなわち、自律神経機能が正常あるいは正常に近い患者では、こむら返りや倦怠感は心拍出量の低下を示す兆候であると考えられる。
一方、自律神経機能が高度に障害されている患者では、心拍出量が低下しても皮膚や骨格筋では細動脈の末端にある毛細血管前括約筋がさほどは収縮せず、すでに述べたように、心拍出量の低下に伴なって血圧が低下していく。そこで、自律神経機能が高度に障害されている患者では、骨格筋の血流量が低下したために筋肉のこむら返りや倦怠感が生じる前に、血圧低下のために心拍出量を増大させる処置を
講じなければならなくなる。
文献
1. Henderson WL: Symptomatic hypotension during hemodialysis. Kidney Int 17: 571–576, 1980.
2. Goetz KL, et al.: Atrial stretch increases sodium excretion independently of release of atrial peptides. Am J. Physiol 250: R946-R950, 1986.
3. Edwards BS, et al.: Atrial stretch, not pressure, is the principal
determinant controlling the acute release of atrial naturiuretic factor.
Circulation research 62: 191-195, 1988.