 蛋白摂取量とカロリー摂取量との間には強い相関が認められる。したがって、食欲不振は蛋白摂取量の低下の原因となるだけでなく、カロリー摂取量の低下の原因ともなる。カロリー摂取量が不足すると、まずエネルギー源として体内に蓄えられている糖質や脂質が利用される。そして、これらの蓄えが減少していくと、次には体蛋白質の分解が促進され、エネルギー源として利用されるようになる。その結果、体蛋白質量は減少する。
蛋白摂取量とカロリー摂取量との間には強い相関が認められる。したがって、食欲不振は蛋白摂取量の低下の原因となるだけでなく、カロリー摂取量の低下の原因ともなる。カロリー摂取量が不足すると、まずエネルギー源として体内に蓄えられている糖質や脂質が利用される。そして、これらの蓄えが減少していくと、次には体蛋白質の分解が促進され、エネルギー源として利用されるようになる。その結果、体蛋白質量は減少する。4.26 蛋白栄養状態を悪化させる要因
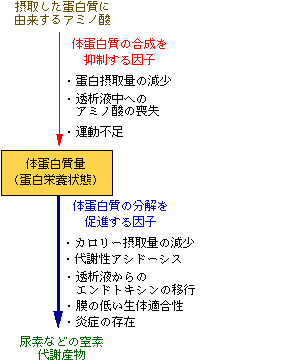
1. 体蛋白質量の増減を決定する要素
蛋白栄養状態の定義である体蛋白質量は、体蛋白質の合成(同化)速度と分解(異化)速度によって決まる。すなわち、体蛋白質の合成速度よりも分解速度の方が大きければ、体蛋白質量は減少し、逆に体蛋白質の合成速度よりも分解速度の方が小さければ、体蛋白質量は増加する。当然、体蛋白質の合成速度と分解速度が等しければ、体蛋白質量は変化しない。
2. 体蛋白質の合成速度を低下させる因子
a) 蛋白摂取量の減少
体蛋白質の合成速度に影響を与える最も大きな因子は、食事による蛋白摂取量である。蛋白摂取量が増加すれば、体蛋白質の材料であるアミノ酸が大量に供給されるために体蛋白質の合成速度は増し、蛋白摂取量が減少すれば、体蛋白質の材料であるアミノ酸の供給が減少するために体蛋白質の合成速度は低下する。
透析患者における蛋白摂取量の減少の原因には、食欲不振に加えて過大な体重増加や血清リン濃度の上昇を気にしての意図的な食事の抑制がある。食欲不振は、運動不足、鬱(うつ)状態あるいは消化器疾患などの様々な要因で生じる。分子量が1,000ないし5,000の血清分画に食欲不振を生じさせる尿毒症物質が存在するとの報告もある[1]。
糖尿病患者は、ときに「食欲がなく、また少し食べただけで満腹になる」と訴える。この症状の原因が胃不全麻痺(gastroparesis)であることがある[2]。胃不全麻痺では、胃ぜん動の低下のために食物の胃内への滞留時間が延長し、摂取した食物の吸収が遅れ、食欲が低下する。早朝空腹時に胃内視鏡検査で前の晩に摂取した食物を胃内に認めれば、胃不全麻痺の存在は確実である。胃不全麻痺の治療については別の項で述べる。
b) 透析液中へのアミノ酸の喪失
透析液にはアミノ酸が含まれていないため、透析中には透析液中にアミノ酸が喪失する。例えば、ポリスルホン膜(PS膜)を用いた場合には1回の透析で約6〜10
gのアミノ酸が喪失すると報告されている[3]。
なお、透析液へのアミノ酸の喪失は、Kt/Vが増大するとともに増加していく。Kt/Vが高すぎるときに死亡のリスクが増大する理由の少なくともひとつは、透析液中へのアミノ酸喪失の増加かもしれない。
c) 運動不足
筋肉トレーニングにより筋肉量が増大することはよく知られている。すなわち、運動は体蛋白質量(筋肉量)を増やす有効な方法のひとつであると思われる。しかし、虚血性心疾患の存在や患者の意欲の低下などの理由で、積極的な運動療法を体蛋白質量を増やす手段として用いるのは現実的には困難であると思われる。
3. 体蛋白分解(蛋白異化)を促進する因子
体蛋白質の分解を促進する因子には、(1)尿毒症物質の蓄積、(2)代謝性アシドーシス、(3)カロリー摂取不良、(4)運動不足、(5)マクロファージによるサイトカインの分泌、(6) 炎症の存在などがある。透析患者では、しばしば、上記の体蛋白質の分解を促進する因子の中のいくつかが存在するために体蛋白質の分解が亢進している状態にある。
a) カロリー摂取量の減少
 蛋白摂取量とカロリー摂取量との間には強い相関が認められる。したがって、食欲不振は蛋白摂取量の低下の原因となるだけでなく、カロリー摂取量の低下の原因ともなる。カロリー摂取量が不足すると、まずエネルギー源として体内に蓄えられている糖質や脂質が利用される。そして、これらの蓄えが減少していくと、次には体蛋白質の分解が促進され、エネルギー源として利用されるようになる。その結果、体蛋白質量は減少する。
蛋白摂取量とカロリー摂取量との間には強い相関が認められる。したがって、食欲不振は蛋白摂取量の低下の原因となるだけでなく、カロリー摂取量の低下の原因ともなる。カロリー摂取量が不足すると、まずエネルギー源として体内に蓄えられている糖質や脂質が利用される。そして、これらの蓄えが減少していくと、次には体蛋白質の分解が促進され、エネルギー源として利用されるようになる。その結果、体蛋白質量は減少する。
なお、上述のように、通常、カロリー摂取量が減少する場合には、同時に蛋白摂取量も減少するので、体蛋白質の合成速度も低下する。
b) 代謝性アシドーシス
代謝性アシドーシスは体蛋白質の分解を促進すると報告されている。体蛋白質の分解にはいくつかの経路があるが、それらのうちubiquitinを介するATP依存性蛋白分解経路がアシドーシスにより刺激されるとされている[4]。また、アシドーシスによりアルブミン合成が低下するとの報告もある[5]。
c)
透析液から体内へのエンドトキシンの移行
エンドトキシンは、マクロファージのサイトカイン分泌を刺激する。サイトカインは体蛋白質の分解を促進する。したがって、エンドトキシンにより高度に汚染された透析液を使用すると、体蛋白質の分解が促進される可能性がある。とくに、ハイパファーマンス膜を使用している場合には、透析液から体内へのエンドトキシンの移行量が増大する。
d) 膜の生体適合性
透析膜は補体を活性化し、またマクロファージのサイトカイン分泌を促進する。透析膜と血液との接触により補体が活性され、あるいはサイトカインが遊離すると、蛋白異化が促進される可能性があるが、その証拠を直接示した報告はまだ存在しない。再生セルロース膜はポリアクリロニトリル膜(PAN膜)、ポリメチルメタクリレート膜(PMMA膜)、エチレンビニルアルコール膜(EVAL膜)、ポリスルホン膜(PS膜)、ポリアミド膜(PA膜)、ポリエステル系ポリマーアロイ膜(PEPA膜)などの合成膜や酢酸セルロース膜(CA膜)に比して補体を活性化し、あるいはマクロファージのサイトカイン分泌を刺激する作用が強い。
e) 炎症の存在
CRPなどの急性相蛋白の産生亢進時には、血清アルブミン濃度の低下やクレアチニン産生量が減少する。このことから、炎症と栄養障害との間には密接な関係の存在する可能性が指摘されている[6]。
4. 至適蛋白摂取量
蛋白摂取量が増えるとリンや塩分の摂取量も増加する。ところが、血清リン濃度が高いと死亡のリスクが増大する。また、体重増加率が増大するとやはり死亡のリスクは増大する。さらに、蛋白摂取量が多いほど、毒性のある尿毒症物質の産生量は増えると思われる。これらは蛋白摂取量を増やした際のマイナス要因でる。一方、蛋白摂取量が増えると、体蛋白質の合成速度が増大して体蛋白質量が増加する。これは蛋白摂取量を増やした際のプラス要因である。これらの蛋白摂取のマイナス要因とプラス要因のバランスの上で至適蛋白摂取量が決定されると考えられる。
死亡のリスクを最小にするnPCR値、すなわち至適nPCR値が患者ごとに異なるのは、このような理由によるのだろう(nPCR値は蛋白摂取量を反映する)。リン吸着剤の投与あるいは透析による効率的なリンの除去により食事量が増えても血清リン濃度がさほど上昇しないようにし、あるいは薄味の食生活にして食事量が増えても体重増加率がさほど大きくならないようにすれば、至適nPCR値(至適蛋白摂取量)は上昇して生命予後はさらに改善されるものと考えられる。
文献
1. Bergström J, Mamoun H, Anderstram B, et al.: Nutrition and adequacy of dialysis. How do hemodialysis and CAPD compare? Kidney Int. 43(Suppl 40): S39-S50, 1993.
2. Horowitz M, Fraser R: Disordered gastric motor function in diabetes mellitus. Diabetologia. 37: 543-551, 1994.
3. Ikizler TA, Flakoll PJ, Parker RA, et al.: Amino acid and albumin losses during hemodialysis. Kidney Int 46: 830-837, 1994.
4. Bailey JL, Wang X, England BK, et al.: The acidosis of chronic renal failure activates muscle proteolysis in rats by augmenting transcription of genes encoding proteins of theATP-dependent ubiquitin-proteosome pathway. J Clin Invest 97: 1447-1453, 1996.
5. Ballimer PE, McNurlan MA, Hulter HN, et al: Chronic metabolic acidosis decreases albumin synthesis and induces negative nitrogen balance. J Clin Invest 95: 39-45, 1995.
6. Stenvinkel P, Heimbiirger O, Paultre F, et al.: Strong association between malnutrition, inflammation, and atherosclerosis in chronic renal failure. Kidney Int 55: 1899-1911, 1999.